Coronavirus, Zika, Ebola, Grippe, sogar die langweilige alte Erkältung – wir alle kennen die Viren, die die Menschheit plagen. Aber obwohl wir wissen, dass sie uns krank machen, mag es überraschend sein zu entdecken, dass wir es über Millionen von Jahren geschafft haben, diese listigen Eindringlinge zu bändigen und zu zähmen.
Von den frühesten Lebensphasen bis zum Lächeln auf unseren Gesichtern haben Viren einen enormen Einfluss auf unsere menschliche Spezies gehabt.
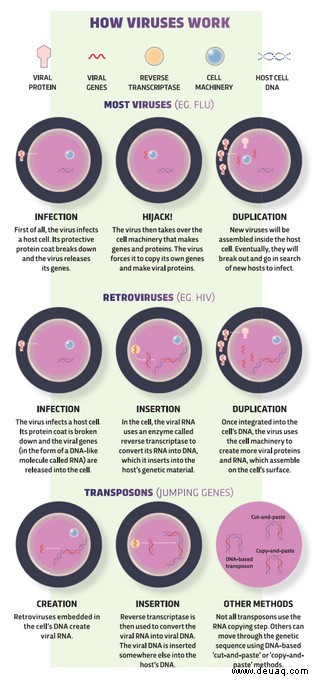
Wie Viren funktionieren
Viren sind kaum mehr als eine Kette von Genen (normalerweise in Form eines Moleküls namens RNA), die in eine Proteinhülle verpackt sind, und sie funktionieren alle auf die gleiche grundlegende Weise.
Sobald ein Virus eine Zelle infiziert hat, entführt es die eigene molekulare Maschinerie der Zelle, um ihre Gene zu kopieren und virale Proteine auszustoßen. Aus diesen frisch hergestellten Teilen werden neue Viren zusammengesetzt, die schließlich auf der Suche nach neuen Angriffszellen ausbrechen.
Für die meisten Viren, wie die Grippe, endet die Geschichte dort. Aber eine Handvoll Retroviren – einschließlich HIV – sind noch hinterhältiger und schmuggeln sich in unsere DNA ein. Sie fügen sich zufällig in das Genom eines Organismus ein und verstecken sich, bis der richtige Zeitpunkt gekommen ist, um die Virusproduktion wieder aufzunehmen.
Aber sobald ein Retrovirus in die DNA eines Organismus eingedrungen ist, gibt es keine Garantie dafür, dass es dort bleibt. Die genetischen Anweisungen können aus dem eingebetteten Virus „gelesen“, in DNA umgewandelt und dann an einer anderen Stelle im Genom eingefügt werden. Wiederholen Sie diesen Zyklus immer wieder und es bauen sich schnell mehrere Kopien der viralen DNA auf.
Über Millionen von Jahren mutieren und verändern sich diese viralen DNA-Sequenzen zufällig und verlieren ihre Fähigkeit, sich von ihren Wirtszellen zu lösen. Einige dieser „endogenen“ Retroviren, die im Genom gefangen sind, können immer noch herumspringen, während andere für immer dort festsitzen, wo sie zuletzt gelandet sind.
Und wenn eines dieser Ereignisse in den Keimzellen passiert, die Eier und Spermien produzieren, werden sie über Generationen weitergegeben und schließlich zu einem dauerhaften Bestandteil des Genoms eines Organismus.
Etwa die Hälfte des menschlichen Genoms besteht aus Millionen von DNA-Sequenzen, die auf längst tote Viren oder ähnliche „springende Gene“ zurückgeführt werden können, die zusammen als transponierbare Elemente oder Transposons bezeichnet werden.
Einige Forscher würden diese Zahl sogar auf 80 Prozent setzen, da alte Sequenzen jetzt über den Punkt hinaus degradiert werden, an dem sie erkennbar virusähnlich sind, im Genom verwittert wie molekulare Fossilien.
Viele Jahre lang wurden die großen Stücke repetitiver, von Viren stammender DNA, die das menschliche Genom verunreinigen, als „Müll“ abgetan. Ein Teil dieses sich wiederholenden Zeugs ist zweifellos kaum mehr als Müll in unserem genetischen Stamm, aber je genauer die Forscher einzelne virale Elemente betrachten, desto differenzierter zeichnet sich ein Bild ab.
Und es stellt sich heraus, dass einige der in unser Genom eingebetteten Viren nicht nur unsere genetischen Feinde, sondern auch unsere Sklaven geworden sind.
Syncytin-Evolution
Vor rund 15 Jahren entdeckten US-Forscher ein menschliches Gen, das nur in der Plazenta aktiv war. Sie nannten es Syncytin, weil es ein Molekül herstellt, das Plazentazellen miteinander verschmilzt und eine spezielle Gewebeschicht bildet, die als Synzitium bekannt ist. Seltsamerweise sieht Syncytin dem Gen eines Retrovirus sehr ähnlich.
Später wurde ein weiteres Syncytin-Gen entdeckt, das ebenfalls an der Bildung der Plazenta beteiligt ist und verhindert, dass das Immunsystem der Mutter den Fötus in ihrer Gebärmutter angreift. Auch hier sieht das Gen so aus, als ob es von einem Retrovirus stammt.
Aber während Menschen und andere große Primaten die gleichen zwei Syncytin-Gene haben, werden sie bei keinem anderen Säugetier mit ähnlich verschmolzenen Zellschichten in der Plazenta gefunden.
Mäuse haben auch zwei Syncytin-Gene:Sie machen die gleiche Arbeit wie die menschliche Version, aber sie sehen aus wie völlig andere Viren. Und es gibt ein weiteres separates, viral abgeleitetes Syncytin-Gen bei Katzen und Hunden, die beide von denselben fleischfressenden Vorfahren abstammen.
Offensichtlich wurden all diese Säugetierarten vor Millionen von Jahren von bestimmten Viren infiziert. Im Laufe der Zeit wurden diese Viren genutzt, um eine Schlüsselrolle beim Wachstum der Plazenta zu spielen, wodurch sie zu einem festen Bestandteil unseres Genoms wurden.
Interessanterweise haben Schweine und Pferde keine Schicht fusionierter Zellen in ihrer Plazenta, und sie haben auch keine Gene, die wie von Viren stammende Syncytine aussehen. Vielleicht haben sie sich also nie einen dieser fusionierenden Viren eingefangen.
Springende Gene
Während der Fall von Syncytin die umfassende Adoption eines Virusgens aufzeigt, um unsere Wünsche zu erfüllen, gibt es viele weitere Beispiele dafür, wie alte Virussequenzen die Genaktivität beim heutigen Menschen beeinflussen können.
Bereits in den 1950er Jahren enthüllte eine akribische Detailarbeit der lange übersehenen amerikanischen Genetikerin Barbara McClintock, dass „springende Gene“ das Genom von Maispflanzen beeinflussen könnten.
Und genau wie die „springenden Gene“, die McClintock im Mais identifizierte, sind die endogenen Retroviren, die in unserem eigenen menschlichen Genom lauern, seit Millionen von Jahren unterwegs, springen willkürlich herum und verändern die Aktivität von Genen in ihrer unmittelbaren Umgebung. P> 
Unsere Zellen investieren viel Energie in den Versuch, diese viralen Elemente daran zu hindern, in die Luft zu gehen. Sie sind mit chemischen Markierungen, sogenannten epigenetischen Markierungen, gekennzeichnet und gesichert. Aber wenn sich die viralen Elemente bewegen, bewegen sich diese molekularen Schalldämpfer mit ihnen, sodass sich die Auswirkungen der viralen Sequenzen auf benachbarte Gene ausbreiten können, wo immer sie landen.
Umgekehrt sind Viren auch voller DNA-Sequenzen, die Moleküle anziehen, die Gene anschalten. In einem funktionierenden Retrovirus aktivieren diese „Schalter“ die viralen Gene, sodass es wieder infektiös werden kann. Aber wenn eine virusähnliche Sequenz in eine andere Region des Genoms gespleißt wird, kann diese Fähigkeit, als genetischer Schalter zu fungieren, schiefgehen.
Im Jahr 2016 fanden Wissenschaftler der University of Utah heraus, dass ein endogenes Retrovirus im menschlichen Genom – das ursprünglich von einem Virus stammte, das unsere Vorfahren vor etwa 45 Millionen bis 60 Millionen Jahren infizierte – ein Gen namens AIM2 einschaltet, wenn es ein Molekül namens Interferon, das „Gefahrensignal“, das den Körper warnt, dass er an einer Virusinfektion leidet. AIM2 zwingt dann die infizierten Zellen zur Selbstzerstörung, um zu verhindern, dass sich die Infektion weiter ausbreitet.
Diese alten Viren sind zu „Doppelagenten“ geworden, die unseren Zellen helfen, andere Viren zu bekämpfen, die versuchen, uns anzugreifen.

Ein weiteres Beispiel für ein Virus, das unsere Spezies geformt haben könnte, findet sich in der Nähe eines Gens namens PRODH. PRODH kommt in unseren Gehirnzellen vor, insbesondere im Hippocampus.
Beim Menschen wird das Gen durch einen Kontrollschalter aktiviert, der aus einem längst toten Retrovirus besteht. Schimpansen haben auch eine Version des PRODH-Gens, aber es ist in ihrem Gehirn nicht annähernd so aktiv.
Eine mögliche Erklärung ist, dass ein alter Virus vor Millionen von Jahren eine Kopie von sich selbst neben PRODH in einen unserer längst verstorbenen Vorfahren hüpfte, aber dass dies bei den Primaten der Vorfahren, die sich zu den heutigen Schimpansen entwickelten, nicht geschah.
Heutzutage wird angenommen, dass PRODH-Fehler an bestimmten Hirnerkrankungen beteiligt sind, sodass es sehr wahrscheinlich ist, dass es zumindest einen gewissen Einfluss auf die Verdrahtung des menschlichen Gehirns hatte.
In ähnlicher Weise sind Variationen in genetischen Schaltern für die Unterschiede zwischen den Zellen verantwortlich, die unsere menschlichen Gesichter bilden, wenn wir im Mutterleib wachsen, und denen von Schimpansen. Obwohl unsere Gene praktisch identisch mit den Genen von Schimpansen sind, sehen wir sicherlich nicht gleich aus. Der Unterschied muss also in den Steuerschaltern liegen.
Nach ihren DNA-Sequenzen zu urteilen, scheinen viele der Schalter, die in den Zellen aktiv sind, die unsere Gesichter wachsen lassen, ursprünglich von Viren zu stammen, die irgendwann auf unserer evolutionären Reise zu der plattgesichtigen Spezies, die wir heute sind, an ihren Platz gesprungen sein müssen.
Die Virenbändiger
Wissenschaftler suchen nicht nur nach Beispielen für längst tote Viren, die unsere Biologie verändert haben, sondern auch nach den Kontrollmechanismen, die ihre Wirkung untermauern. Die Hauptschuldigen sind spezielle Silencing-Moleküle namens KRAB Zinc Finger Proteins (KRAB ZFPs), die virale Sequenzen im Genom erfassen und an Ort und Stelle fixieren.
Prof. Didier Trono und sein Team an der Universität Lausanne in der Schweiz haben mehr als 300 verschiedene KRAB-ZFPs im menschlichen Genom entdeckt, von denen jedes ein anderes virales DNA-Ziel zu bevorzugen scheint. Dort helfen sie, die molekulare Maschinerie zu rekrutieren, die Gene ein- oder ausschaltet.
„Diese KRAB-ZFPs wurden als ‚Killer‘ dieser endogenen Retroviren angesehen“, erklärt Trono. „Aber sie sind tatsächlich Ausbeuter dieser Elemente, die es dem Organismus ermöglichen, den Reichtum an Möglichkeiten auszuschöpfen, der in diesen viralen Sequenzen steckt.“
Trono und sein Team glauben, dass KRAB-ZFPs das fehlende Bindeglied zwischen viralen Sequenzen sind, die aktiv schädlich sind, und solchen, die zu gezähmten Kontrollschaltern geworden sind.
Sie haben Hinweise darauf, dass sich die Proteine neben den viralen Elementen in einer Art „Wettrüsten“ entwickelt haben, sie zunächst unterdrückten, aber schließlich überwältigten.
„Wir glauben, dass sie diese Elemente domestizieren“, sagt Trono. „Und mit Domestizierung meine ich nicht nur sicherzustellen, dass die Viren an Ort und Stelle bleiben, sondern sie in etwas Nützliches für den Wirt zu verwandeln, was eine sehr raffinierte Art ist, die Genaktivität in allen möglichen Zellen und Situationen zu regulieren.“
Untermauert wird diese Idee durch den Befund, dass unterschiedliche Gruppen von KRAB-ZFPs in verschiedenen Zelltypen aktiv sind. Sie kommen auch in bestimmten Mustern bei verschiedenen Arten vor.
Wenn sie nur Viren unterdrücken würden, so das Argument, müsste in allen Zellen dieselbe Anordnung von Proteinen vorhanden sein. Warum sollten sie außerdem an die vielen Tausend längst toten viralen Elemente gebunden sein, die Trono und sein Team identifiziert haben?
Es hat keinen Sinn, ein totes Retrovirus zu unterdrücken, also müssen sie eine wichtige Rolle bei der Kontrolle der Genaktivität spielen.
Obwohl seine Idee immer noch ein wenig umstritten ist, sieht Trono die KRAB-ZFPs als eine Kraft viraler Sklaventreiber, die sich diese Elemente zunutze machen, um unsere Befehle auszuführen und sie in genetische Kontrollschalter umzuwandeln.
Über viele Millionen Jahre könnte dies ein starker Motor gewesen sein, um neue Arten zu erschaffen. Wenn zum Beispiel ein Virus zufällig in einem angestammten Geschöpf und nicht in einem anderen auftaucht und dann im Laufe der Zeit von einem KRAB-ZFP gezähmt wird, erzeugt es neue Steuerschalter, die einen großen Einfluss auf das Aussehen oder Verhalten eines Tieres haben könnten.
Darüber hinaus werden diese Sprungelemente in Zeiten von Umweltveränderungen aktiver. Wenn die Zeiten hart werden, müssen Arten neue Wege finden, sich anzupassen, oder sie werden aussterben.
Die Aktivierung dieser mobilen Elemente mischt das Genom neu und bringt neue genetische Variationen hervor, die reichhaltiges Futter für die natürliche Selektion liefern.
Viren:die Guten, die Bösen und die Nützlichen
Es ist klar, dass die in unserem Genom eingeschlossenen Viren uns auf einer evolutionären Zeitskala enorme Vorteile gebracht haben. Aber sie sind nicht alle so hilfreich. Etwa eines von 20 menschlichen Babys wird mit einem neuen viralen „Sprung“ irgendwo in seinem Genom geboren, der ein wichtiges Gen deaktivieren und Krankheiten verursachen könnte.
Es gibt zunehmend Hinweise darauf, dass springende Transposons zum genetischen Chaos in Krebszellen beitragen. Und faszinierende Forschungsergebnisse deuten darauf hin, dass Gehirnzellen besonders gute Orte für die Reaktivierung springender Gene sind, was möglicherweise die Diversität von Nervenzellen erhöht und unsere Gehirnleistung verbessert, aber möglicherweise auch altersbedingte Gedächtnisprobleme und Erkrankungen wie Schizophrenie verursacht.
Sind diese Viren in unserer DNA also unsere Freunde oder unsere Feinde? Paolo Mita, ein Postdoktorand, der Transposons an der NYU School of Medicine in New York erforscht, schlägt vor, dass es ein bisschen von beidem ist.
„Ich nenne sie unsere ‚Feinde‘, denn wenn man sich ihre Rolle in einer menschlichen Lebensspanne ansieht, wird es höchstwahrscheinlich negative Auswirkungen geben, wenn sie mobilisiert werden“, erklärt er. „Kurzfristig sind sie unsere Feinde. Auf der anderen Seite sind diese Elemente, wenn Sie über die Zeit hinwegblicken, eine mächtige Kraft der Evolution, und sie sind auch heute noch in unserer Spezies aktiv.
„Evolution ist einfach die Art und Weise, wie Organismen auf Veränderungen in der Umwelt reagieren, und in diesem Fall sind sie definitiv unsere Freunde, weil sie geformt haben, wie unser Genom jetzt funktioniert.“
Und werden die Viren, die uns heute infizieren, wie etwa HIV, einen Einfluss auf unsere Evolution in der Zukunft haben?
"Natürlich! Die Antwort ist, warum nicht?“ lacht Mita. „Aber es wird viele Generationen dauern, bis wir zurückblicken und sagen können, dass diese Entwicklung stattgefunden hat.
„Aber Sie können die Überreste früherer Wettrüsten im Genom zwischen den endogenen Retroviren und den Wirtszellen sehen. Es ist ein kontinuierlicher Kampf, und ich glaube nicht, dass er jemals aufgehört hat.“